Cuantos de energía es uno de los fundamentos de la muy conocida Física cuántica. Para entenderlo mejor, primero entenderíamos la necesidad de esta nueva física. La ya establecida y muy famosa Física Newtoniana o la Física Clásica, en efecto, respondía a muchas preguntas que molestaban a la humanidad, pero tenía sus propias limitaciones.
¿Por qué falló la Física Clásica?
El modelo anterior de un átomo sugerido por Ernest Rutherford era muy parecido al sistema planetario donde los electrones orbitan el núcleo como los planetas orbitan el sol. Aplicando Física clásica al modelo sugiere un equilibrio de la fuerza de atracción coulómbica entre el electrón y el núcleo, y la fuerza centrífuga de acción externa. Se formularon muchos parámetros usando esta ecuación de equilibrio de fuerzas.

Sin embargo, de acuerdo con lo establecido Teoría electromagnéticauna partícula cargada acelerada emite radiación electromagnética. Ahora bien, si un cuerpo emite radiación electromagnética pierde su energía, y por lo tanto la energía de un electrón en órbita se reducirá y finalmente caerá en el núcleo, lo que ciertamente no es el caso. Esta gran falla de la física clásica preparó el camino para una nueva física conocida como Física cuántica.
Aunque la Física Clásica no pudo explicar esto, da excelentes resultados en las consideraciones generales del día a día. Por lo tanto, su aplicación se limita a cosas mucho más grandes que el átomo y también mucho más lentas que la luz.
Introducción a Quanta
A principios del siglo XX, un físico alemán, Max Planck estudiaba las radiaciones emitidas por un cuerpo negro, y para explicarlo completamente se le ocurrió esta teoría de la cuantificación. Fue el primero en hablar de cuantificación. Según él, las radiaciones electromagnéticas sólo pueden ser emitidas de forma discreta y no continua. Sugirió que todas las radiaciones electromagnéticas, y por lo tanto la luz también, se emiten en ciertos paquetes de energía que él llamóquantao más precisamente los cuantos de energía. Por lo tanto, asoció la energía de una radiación con la frecuencia f como
E = hf
Donde, E es la energía asociada, h es la constante de Plancks (= 6.626 10-34 Joule segundo)
Por lo tanto, la energía sólo puede ser transferida de manera cuantificada, es decir, sólo en múltiplos integrales de la constante de Plancks. Más tarde Einsteins Efecto fotoeléctrico también llevó a la misma conclusión. Extendió la idea de Plancks y dijo que no sólo la emisión o la absorción, sino la energía en sí misma se cuantifica.
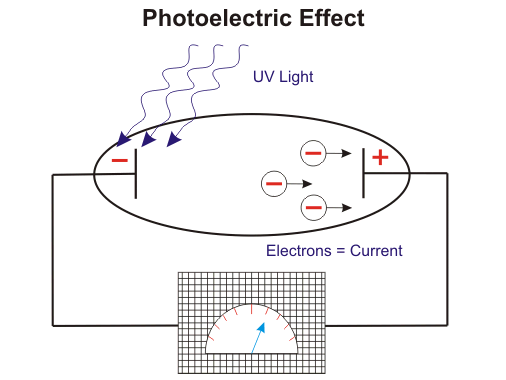

El origen mismo de los cuantos de energía puede atribuirse al desarrollo ulterior modelo de átomo de Neils Bohr. Aplicó la idea de Planck a la física atómica y dio un modelo en el que los electrones orbitan alrededor del núcleo pero en órbitas distintas y fijas. Una órbita fija implica, una energía fija y por lo tanto no hay caída de electrones en el núcleo. La órbita se define como un nivel de energía en el que los electrones permanecen y se les permite transitar de un nivel a otro. El nivel cercano al núcleo tiene una energía menor que el lejano. Por lo tanto, si un electrón cae de un nivel superior a otro inferior, obtenemos una energía igual a la diferencia de los dos niveles y un electrón sólo saltará a un nivel superior si se le proporciona una energía igual a la diferencia. Esto se conoce como salto cuántico. Si proporcionamos una energía inferior a la diferencia, permanecerá en el mismo nivel.
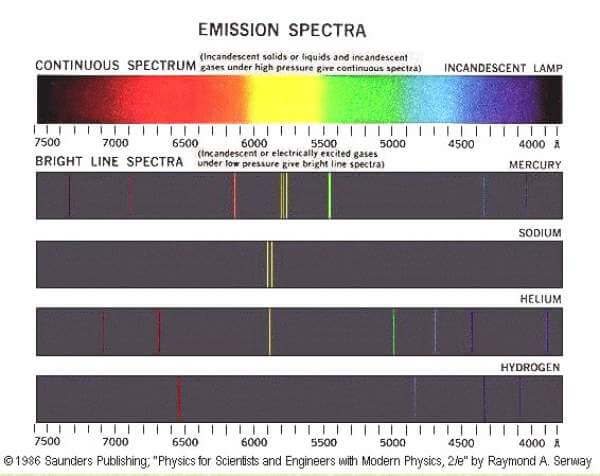

Este modelo también explicaba los patrones espectrales únicos que exhibían los diferentes elementos. La energía correspondiente a cada color del patrón se encuentra igual a la diferencia en el nivel de energía de varias órbitas. Cuanto mayor sea el salto, es decir, el salto orbital más alto es la energía asociada y más cerca está su color del extremo violeta del espectro en el patrón espectral. Si no hubiera habido niveles fijos de energía, los espectros emitidos por un átomo excitado serían continuos desde el rojo hasta el violeta, lo que ciertamente no es el caso. Por lo tanto, Modelo Bohrs explicaba la discreción de la energía.