Aplicaciones de la electrólisis
Refinamiento electrolítico de metales
El proceso de refinación electrolítica de metales se utiliza para extraer las impurezas de los metales crudos. Aquí en este proceso, un bloque de metal crudo se utiliza como ánodo, una sal diluida de ese metal se utiliza como electrolito y las placas de ese metal puro se utilizan como cátodo.
Refinamiento electrolítico del cobre
Para entender el proceso de refinación electrolítica de metalesdiscutiremos sobre un ejemplo de refinación electrolítica del cobre. El cobre extraído de su mineral, conocido como cobre ampollado, tiene una pureza del 98 al 99%, pero puede ser fácilmente elaborado hasta el 99,95% de pureza para su aplicación eléctrica mediante el proceso de electrorefinición.
En este proceso de electrolisisutilizamos un bloque de cobre impuro como ánodo o electrodo positivo, sulfato de cobre acidificado con ácido sulfúrico, como electrolito y placas de cobre puro recubiertas de grafito, como cátodo o electrodo negativo.
El sulfato de cobre se divide en un ión de cobre positivo (Cu+ +) y el ión sulfato negativo (SO4 ). El ión de cobre positivo (Cu+ +) o cationes se moverán hacia el electrodo negativo de cobre puro donde toma los electrones del cátodo, y se convierte en el átomo de Cu y se deposita en la superficie de grafito del cátodo.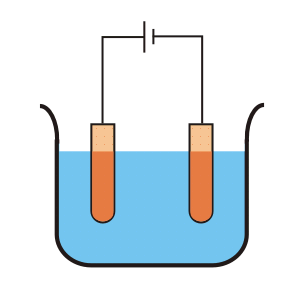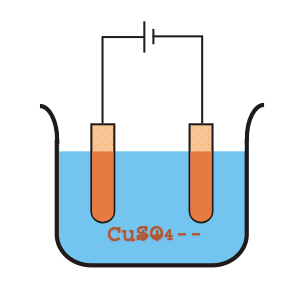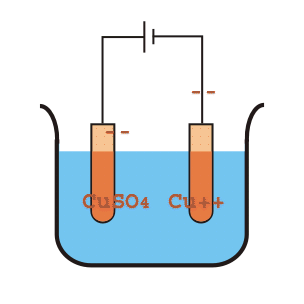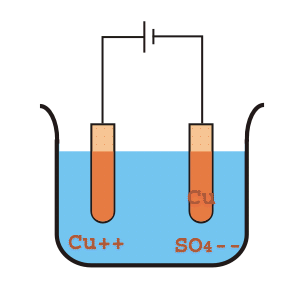

Por otro lado, el SO4 se moverá hacia el electrodo positivo o el ánodo donde recibirá electrones del ánodo y se convertirá en el radical SO4 pero como SO radical4 no puede existir solo, atacará el cobre del ánodo y formará CuSO4. Este CuSO4 se disolverá y se dividirá en la solución como un ión de cobre positivo (Cu+ +) y el ión sulfato negativo (SO4 ). Estos iones de cobre positivos (Cu+ +) se moverá entonces hacia el electrodo negativo donde toma los electrones del cátodo, y se convierten en átomos de Cu y se depositan en la superficie de grafito del cátodo. De esta manera, el cobre del crudo impuro será transferido y depositado en la superficie de grafito del cátodo.
Las impurezas metálicas del ánodo también se fusionan con el SO4formando sulfato metálico y se disuelven en la solución electrolítica. Las impurezas como la plata y el oro, que no son afectadas por la solución de ácido sulfúrico y sulfato de cobre, se asentarán como el lodo o el fango del ánodo. En un intervalo regular de refinado electrolítico del cobre, el cobre depositado se extrae del cátodo y del ánodo y se reemplaza por un nuevo bloque de cobre crudo.
NB :- En el proceso de refinación electrolítica de metales o simplemente electro refinación, el cátodo es cubierto por grafito de manera que el químico depositado, puede ser fácilmente removido. Esta es una de las aplicaciones muy comunes de la electrólisis.
Electrochapado
El proceso de electrodeposición es teóricamente igual que la electrorefinición, la única diferencia es que, en lugar de un cátodo recubierto de grafito tenemos que colocar un objeto en el que el electrodeposición tiene que hacerse. Tomemos un ejemplo de una llave de latón que se va a revestir de cobre utilizando electrodeposición de cobre.
Electrodeposición de cobre
Ya hemos afirmado que el sulfato de cobre se divide en un ión de cobre positivo (Cu+ +) y el ión sulfato negativo (SO4 ) en su solución. Para electrodeposición de cobreutilizamos una solución de sulfato de cobre como electrolito, cobre puro como ánodo y un objeto (una llave de latón) como cátodo. La varilla de cobre puro está conectada con el terminal positivo y la llave de latón está conectada con el terminal negativo de una batería. Mientras que esta varilla de cobre y la llave están sumergidas en una solución de sulfato de cobre, la varilla de cobre se comportará como ánodo y la llave se comportará como cátodo. Como el cátodo o la llave de latón está conectado con el terminal negativo de la batería, atraerá los cationes positivos o Cu+ + y al llegar a los iones de Cu+ + iones en la superficie de la llave de latón, recibirán electrones de ella, se convertirán en átomo de cobre neutro y están a punto de depositarse en la superficie de la llave de latón como capa uniforme. El sulfato o el SO4 los iones se mueven al ánodo y extraen el cobre de él en la solución como se menciona en el proceso de electro-refinado. Para un correcto y uniforme revestimiento de cobre, el objeto (aquí es la llave de latón) está siendo girado lentamente en la solución.
Electroconformado
La reproducción de objetos por electro-deposición en algún tipo de molde se conoce como electroconformado. Este es otro ejemplo muy útil entre muchas aplicaciones de la electrólisis. Para ello, primero tenemos que tomar la impresión de los objetos en cera o en otro material similar a la cera. La superficie del molde de cera que lleva la impresión exacta del objeto, se recubre con polvo de grafito para que sea conductor. Luego el molde se sumerge en la solución electrolítica como cátodo. Durante el proceso de electrólisis, el metal electrolítico se depositará en la superficie impresa recubierta de grafito del molde. Después de obtener una capa del grosor deseado, se retira el artículo y se funde la cera para obtener el objeto reproducido en forma de carcasa metálica. Un uso popular de electroconformado es la reproducción de los dados del disco del gramófono. La grabación original se hace en un disco de composición de cera. Este molde de cera se recubre con polvo de oro para que sea conductor. Luego este molde se sumerge en un electrolito de vitriolo azul como cátodo. La solución se mantiene saturada usando un ánodo de cobre. El cobre electroformado en el molde de cera produce una placa maestra que se utiliza para estampar un gran número de discos de laca.