Las leyes de la electrólisis de Faraday
Antes de entender Las leyes actuales de la electrólisisprimero debemos entender el proceso de electrolisis de un sulfato de metal.
Cada vez que un electrolito como el sulfato de metal se diluye en agua, sus moléculas se dividen en iones positivos y negativos. Los iones positivos (o iones de metal) se mueven a los electrodos conectados con el terminal negativo del batería donde estos iones positivos toman electrones de él, convirtiéndose en un metal puro átomo y se deposita en el electrodo.
Los iones negativos (o sulfones) se mueven al electrodo conectado con el terminal positivo del bateríadonde estos iones negativos renuncian a sus electrones extra y se convierten en SO4 radical. Ya que el SO4 no puede existir en un estado eléctricamente neutro, atacará el electrodo positivo metálico formando un sulfato metálico que se disolverá de nuevo en el agua.
Las leyes actuales de la electrólisis son relaciones cuantitativas (matemáticas) que describen los dos fenómenos anteriores.


La primera ley de electrólisis de Faraday
De la breve explicación anterior, está claro que el flujo de actual a través del exterior batería depende completamente de cuántos electrones se transfieren desde el electrodo o cátodo negativo al ión o cationes metálicos positivos. Si los cationes tienen valencia de dos como el Cu++ entonces por cada catión, habría dos electrones transferidos de cátodo a catión. Sabemos que cada electrón tiene una carga eléctrica negativa 1.602 10-19 Coulombs y decir que es e. Así que para la disposición de cada átomo de Cu en el cátodo, habría 2.e transferencias de carga de cátodo a cación.
Ahora digamos que por t tiempo habría un total de n número de átomos de cobre depositados en el cátodo, por lo que la carga total transferida, sería de 2.n.e Coulombs. La masa m del cobre depositado es obviamente una función del número de átomos depositados. Por lo tanto, se puede concluir que la masa del cobre depositado es directamente proporcional a la cantidad de carga eléctrica que pasa a través del electrolito. Por lo tanto, la masa del cobre depositado m Q cantidad de carga eléctrica pasa a través del electrolito.
La primera ley de electrólisis de Faraday afirma que la deposición química debida al flujo de actual a través de un electrolito es directamente proporcional a la cantidad de electricidad (culombio) que pasa a través de él.
es decir. masa de la deposición química:


Donde, Z es una constante de proporcionalidad y se conoce como equivalente electroquímico de la sustancia.
Si ponemos Q = 1 culombios en la ecuación anterior, obtendremos Z = m, lo que implica que el equivalente electroquímico de cualquier sustancia es la cantidad de la sustancia depositada al pasar 1 culombios por su solución. Esta constante del paso del equivalente electroquímico se expresa generalmente en términos de miligramos por culombio o kilogramo por culombio.
Hoy en día la segunda ley de electrólisis de Faraday
Hasta ahora hemos aprendido que la masa del químico, depositada debido a la electrólisis es proporcional a la cantidad de electricidad que pasa a través del electrolito. La masa del químico, depositada debido a la electrólisis no sólo es proporcional a la cantidad de electricidad que pasa a través del electrolito, sino que también depende de algún otro factor. Cada sustancia tendrá su propio peso atómico. Así que para el mismo número de átomos, diferentes sustancias tendrán diferentes masas.
Una vez más, la cantidad de átomos depositados en los electrodos también depende de su número de valencia. Si la valencia es mayor, entonces para la misma cantidad de electricidad, el número de átomos depositados será menor, mientras que si la valencia es menor, entonces para la misma cantidad de electricidad, más número de átomos a depositar.
Así, para una misma cantidad de electricidad o carga que pasa a través de diferentes electrolitos, la masa de la sustancia química depositada es directamente proporcional a su peso atómico e inversamente proporcional a su valencia.
Hoy en día la segunda ley de la electrólisis de Faraday establece que, cuando la misma cantidad de electricidad pasa a través de varios electrolitos, la masa de las sustancias depositadas es proporcional a su respectivo equivalente químico o peso equivalente.
Equivalente químico o peso equivalente
El equivalente químico o el peso equivalente de una sustancia puede determinarse mediante Las leyes actuales de la electrólisisy se define como el peso de esa subtensión que se combinará o desplazará el peso unitario del hidrógeno.
El equivalente químico del hidrógeno es, por lo tanto, la unidad. Como la valencia de una sustancia es igual al número de átomos de hidrógeno que puede reemplazar o con los que puede combinarse, el equivalente químico de una sustancia, por lo tanto, puede definirse como la relación entre su peso atómico y su valencia.
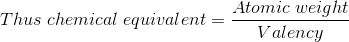
¿Quién inventó las leyes de electrólisis de Faraday?
Las Leyes de Electrólisis de Faraday fueron publicadas por Michael Faraday en 1834. Michael Faraday también fue responsable


Además de descubrir estas leyes de la electrólisis, Michael Faraday es también responsable de popularizar las terminologías como electrodos, iones, ánodos y cátodos.