Vapor puede entenderse mejor, entendiendo el concepto de estructura atómica y la estructura molecular de la materia.
Una molécula es la pequeña cantidad de cualquier elemento o compuesto y que aún posee todas las propiedades químicas de la sustancia. Una molécula en sí misma está compuesta por átomos aún más pequeños. Ejemplo de molécula de agua está hecha de dos átomos de hidrógeno y un átomo de oxígeno.
Dado que el hidrógeno y el oxígeno son abundantes en la atmósfera, el agua está hecha de átomos de hidrógeno y el oxígeno también es abundante. El carbono es el otro elemento que se encuentra en abundancia. Muchas sustancias existen en más de un estado físico, es decir, sólido, líquido y en fase de vapor. Por ejemplo, el agua existe en estado líquido, sólido (hielo) y vapor. La fase o el estado depende de la disposición molecular y de sus límites. La excitación de las moléculas está relacionada con el estado físico de la sustancia.
¿Qué es el Punto Triple?
Vapor puede entenderse mejor, entendiendo el concepto de estructura atómica y la estructura molecular de la materia.
Una molécula es la pequeña cantidad de cualquier elemento o compuesto y que aún posee todas las propiedades químicas de la sustancia. Una molécula en sí misma está compuesta por átomos aún más pequeños. La molécula de agua, por ejemplo, está formada por dos átomos de hidrógeno y un átomo de oxígeno.
Dado que el hidrógeno y el oxígeno son abundantes en la atmósfera, el agua está hecha de átomos de hidrógeno y el oxígeno también es abundante. El carbono es el otro elemento que se encuentra en abundancia.
Muchas sustancias existen en más de un estado físico, es decir, sólido, líquido y en fase de vapor. Por ejemplo, el agua existe en estado líquido, sólido (hielo) y vapor. La fase o el estado depende de la disposición molecular y de sus límites. La excitación de las moléculas está relacionada con el estado físico de la sustancia.
¿Qué es el hielo?
Es el estado sólido, donde las moléculas están encerradas juntas de manera ordenada y por lo tanto no pueden moverse libremente ya que la misma está restringida, pero puede vibrar en su posición media. La aplicación de calor acelera la vibración y resulta en la separación de la misma de los vecinos. Como resultado, el estado sólido comienza a fundirse en el estado líquido.
El derretimiento se produce en el OoC a presión atmosférica sin que el cambio de presión lo afecte.
La aplicación de calor rompe el enlace de la red para producir el cambio de fase manteniendo la temperatura del hielo constante se llama entalpía de fusión o calor de fusión. Este es un fenómeno reversible significa que la congelación se produce cuando la misma cantidad de calor se libera de nuevo a los alrededores.
Normalmente, el cambio de fase (de sólido a líquido) la densidad disminuye pero el agua es la excepción a ello y es la razón por la que el hielo flota en ella.
¿Qué es el agua?
En la fase líquida las moléculas se mueven libremente desde pero aún con menos de un diámetro molecular de separación debido a la atracción mutua y a la colisión que se produce.
En el calor de la fase líquida, la adición aumenta la temperatura del líquido, a medida que aumenta la colisión molecular.
Entalpía líquida o calor sensible (hf) del agua:-
Es el calor que resulta en el cambio de temperatura del agua sin cambiar su fase es la entalpía líquida o el calor sensible del agua.
¿Qué es el vapor?
La temperatura del agua aumenta hasta su punto de ebullición al aplicar calor y en este estado las moléculas que tienen más KE (energía cinética) se desprenden temporalmente de la superficie del líquido y vuelven.
El calentamiento posterior causa una excitación mucho mayor y aumenta el número de moléculas con suficiente energía para salir del líquido. En esta etapa, las moléculas que salen de la superficie del líquido superan a las que regresan. Esto se llama el punto de ebullición del agua, que es igual a la temperatura de saturación del agua.
Caso I: Añadiendo más calor a una presión constante
Estado inicial : Dejemos que la presión constante sea de 2 bares teniendo la disponibilidad
Entalpía del agua (hf) = 504.7 kJ/
Estado final: Después de añadir calor a una presión constante
Entalpía de vapor saturado (hfg) = 2201.9 kJ/Kg
Resultado: La adición de calor a presión constante da lugar a un aumento de la entalpía del vapor saturado hasta 2201,9 kJ/kg desde la de 504,7 kJ/kg, aunque la temperatura del agua hirviendo y del vapor es la misma. El contenido de energía del vapor saturado es mucho mayor que el del agua saturada.
Dada a continuación… vapor curva de saturación, mostrando claramente el aumento de la temperatura de saturación de vapor de con el aumento de la presión.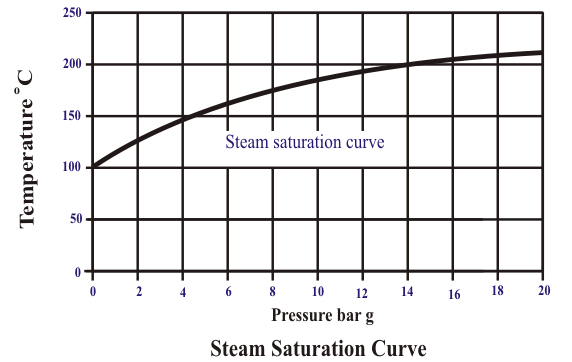

Por lo tanto, se puede concluir que:-
Cualquier aumento adicional de la temperatura por encima de la temperatura de saturación se denomina sobrecalentamiento del vapor.
Aplicando el concepto anterior a la caldera en el planta de energía:
Supongamos que el vapor que sale de la caldera es proporcional a la velocidad a la que se produce en la misma, entonces la adición de calor acelerará la tasa de producción de vapor. Por otra parte, si controlamos parte del vapor que sale de la caldera y luego aumentamos la entrada de calor a la caldera, entonces el flujo de energía hacia la caldera es mayor que la energía que sale de la caldera. Este exceso de energía aumenta la presión de la caldera y, a su vez, la temperatura de saturación del vapor.
La entalpía de la evaporación o el calor latente (hfg)
Es el cuanto de calor (energía) necesario para cambiar el agua de un estado a otro, es decir, el vapor se llama como Entahlpy de la evaporación manteniendo la temperatura sin cambios para la mezcla de vapor y agua. La energía total añadida durante el proceso se utiliza completamente para cambiar el estado del agua a vapor.
Se trata de la energía (entalpía de la evaporación) que se reconoce como la forma más útil de energía, ya que puede ser extraída de nuevo durante la condensación (vapor a agua).
Entalpía del vapor saturado o calor total del vapor saturado (hg)
La energía total o entalpía del vapor saturado se define como la suma de la entalpía de la evaporación y la entalpía del agua.
Entalpía del vapor saturado
Dónde,
hg = Entalpía total de vapor saturado (Energía total/calor) kJ/Kg
hf = Entalpía de Líquido (calor sensible) kJ/Kg
hfg = Evaporación Entahlpy (calor latente) en kJ/Kg
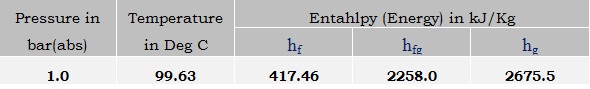
Ejemplo: Usando el vapor cuadro puede establecerse fácilmente que la mayor parte del contenido de calor se encuentra en el vapor saturado, es decir, en la entalpía de evaporación. Como se muestra en el cuadro siguiente, de la entalpía total de (2675,5 kJ/Kg), el 84% es entalpía de evaporación y el 16% restante contribución es de entalpía líquida.