Un átomo se define como la partícula más pequeña de una sustancia que puede existir por sí misma o combinarse con otros átomos para formar una molécula.
En el año 1808, el famoso químico, físico y meteorólogo inglés John Dalton publicó su teoría de la átomo. En ese momento, muchos fenómenos químicos inexplicados fueron rápidamente desbloqueados por la teoría de los Daltons. Por lo tanto, la teoría se convirtió en un fundamento teórico de la química. Los postulados de la teoría atómica de Daltons eran los siguientes.
- Toda la materia está compuesta por pequeñas partículas indivisibles e indestructibles llamadas átomos.
- Todos los átomos del mismo elemento tienen propiedades idénticas pero difieren de los átomos de otros elementos.
- Los átomos de diferentes elementos se combinan para formar un compuesto.
- Una reacción química no es más que un reordenamiento de estos átomos.
- Los átomos no pueden ser creados o destruidos por ningún medio.
La teoría de los Daltons tenía ciertos inconvenientes como; hoy sabemos que los átomos pueden ser destruidos. Además, algunos átomos de los mismos elementos varían en su masa (isótopos). La teoría tampoco explica la existencia de alótropos.
Pero en la era morderna el concepto de átomo se basa en la combinación de los méritos de El modelo atómico de Rutherfords y El modelo atómico de Bohrs. Todas las sustancias están compuestas por átomos. Todos los átomos están compuestos,
- Núcleo
- Electrones
Núcleo del Átomo
El núcleo se encuentra en el centro del átomo. El diámetro del núcleo es de aproximadamente 1/10000 del diámetro del átomo entero. Casi toda la masa del átomo está concentrada en su núcleo. El núcleo en sí mismo consiste en dos tipos de partículas,
- Protón
- Neutrón
Protón
Los protones son partículas con carga positiva. La carga de cada protón es de 1,6 10-19 Coulomb. El número de protones en el núcleo de un átomo representa el número atómico del átomo.
Neutrón
Los neutrones no tienen ninguna carga eléctrica. Significa que los neutrones son partículas eléctricamente neutras. La masa de cada neutrón es igual a la masa del protón.
El núcleo está cargado positivamente debido a la presencia de protones cargados positivamente. En cualquier material, el peso del átomo y las propiedades radiactivas están asociadas al núcleo.
Electrones
Un electrón es una partícula con carga negativa presente en los átomos. La carga de cada electrón es de 1,6 10 – 19 Coulomb. Estos electrones rodean el núcleo. A continuación se enumeran y explican algunos datos sobre los electrones de un átomo,
- Si un átomo tiene el mismo número de protones y electrones, el átomo es eléctricamente neutro ya que la carga negativa de los electrones neutraliza la carga positiva de los protones.
- Los electrones giran alrededor del núcleo en conchas (también llamadas órbitas).
- Una fuerza de atracción es excretada sobre los electrones cargados negativamente por el núcleo cargado positivamente. Esta fuerza de atracción funciona como la fuerza centrípeta necesaria para que los electrones giren alrededor del núcleo.
- Los electrones que están cerca del núcleo están estrechamente ligados al núcleo y es más difícil sacar (remover) estos electrones del átomo que los que están lejos del núcleo.
- La estructura de los átomos de aluminio se muestra en la siguiente figura…
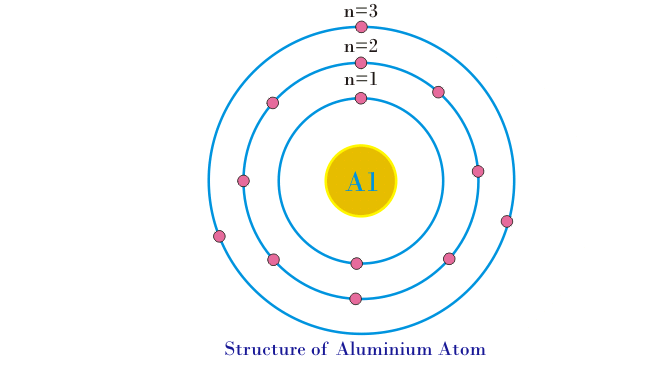

- Se requiere una cantidad definida de energía para sacar el electrón de su órbita. La energía necesaria para retirar el electrón de la primera órbita es mucho mayor en comparación con la energía necesaria para retirar el electrón de la órbita exterior. Esto se debe a que la fuerza de atracción excretada por el núcleo sobre los electrones en la primera órbita es mucho mayor en comparación con la fuerza de atracción excretada sobre los electrones de la órbita exterior. Del mismo modo, la energía necesaria para eliminar el electrón de la segunda órbita será menor en comparación con la primera órbita y mayor que la tercera. Por lo tanto, podemos decir que los electrones de la órbita están asociados con una cantidad definida de energía. Por lo tanto, las órbitas o las conchas también se denominan niveles de energía.
- Los niveles de energía se denotan con las letras K, L, M, N, etc. Donde, K es la órbita más cercana al núcleo y tiene el nivel de energía más bajo. Por el contrario, la órbita más exterior tiene el nivel de energía más alto.
- El número máximo de electrones en cualquier nivel de energía viene dado por, 2n2donde, n es un número entero y representa el número cuántico principal. Para diferentes niveles de energía el valor de n y el número máximo de electrones como se indica en la tabla siguiente
| Sl. No. | Nivel de energía u Órbita (caparazón) | Número cuántico principal n | Número máximo de electrones (2n2) |
| 1 | K | 1 | 2 × 12 = 2 |
| 2 | L | 2 | 2 × 22 = 8 |
| 3 | M | 3 | 2 × 32 = 18 |
| 4 | N | 4 | 2 × 42 = 32 |
- La fórmula anterior (2n2) utilizado para determinar el número máximo de electrones en cualquier envoltura, tiene algunas limitaciones. El número de electrones en la capa más externa (el nivel de energía más alto) no puede exceder de 8. Por ejemplo, consideremos el átomo de calcio, que tiene 20 electrones orbitando alrededor de su núcleo. Según la fórmula de la regla anterior, es decir, 2n2la distribución de los electrones será de 2 electrones en el nivel K, 8 electrones en el nivel L y habrá un equilibrio de 10 electrones. Pero los electrones en el nivel más externo de energía no pueden exceder 8. Por lo tanto, habrá 8 electrones en el nivel M y los 2 electrones restantes irán al siguiente nivel de energía, es decir, 2 electrones irán al nivel N. La configuración de electrones del átomo de calcio se muestra en la siguiente figura.
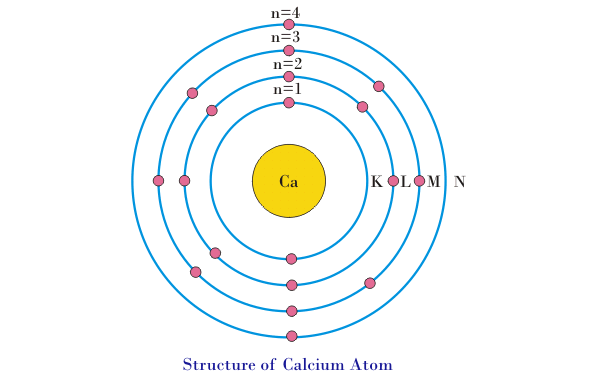

- Los electrones del nivel de energía más externo se llaman electrones de valencia. El máximo número posible de electrones de valencia es 8. Si el número de electrones en la órbita más exterior es 8, el átomo se estabiliza. El material cuyos átomos tienen naturalmente 8 electrones en su capa más exterior (órbita), no reacciona con otro material. Los gases inertes como el helio, el neón, el argón, el criptón, etc., han llenado completamente la mayoría de las capas exteriores y por lo tanto no reaccionan con otros materiales.
- Los electrones de valencia de un átomo están vagamente unidos al núcleo y pueden ser liberados / eliminados por un método diferente, es decir, mediante el calentamiento, la aplicación de voltaje eléctrico, etc.
- Los electrones de valencia forman los enlaces para mantener los átomos de la materia juntos. La mayoría de las propiedades de los materiales están determinadas por estos enlaces en los materiales.
- Cada capa principal (nivel de energía) se subdivide en subcapas. Estas subcapas se llaman orbitales. Estas sub-capas/orbitales son designadas por s, p, d, f etc. con sus correspondientes número cuánticol = 0, 1, 2, 3, 4,… n-1, etc. El número de subcáscaras en cualquier cubierta principal es igual al número cuántico principal n. La capacidad de electrones de cualquier cubierta principal puede determinarse sumando la capacidad de electrones de las subcáscaras. La capacidad máxima de electrones de las subcáscaras se rige por la fórmula de 2(2l +1 ). Las capacidades de las subcáscaras se indican en la tabla siguiente
| Sl. No. | Subshell | Número cuántico (l) | La capacidad de los electrones de la subcapa 2(2l + 1) |
| 1 | s | 0 | 2(2 × 0 + 1) = 2 |
| 2 | p | 1 | 2(2 × 1 + 1) = 6 |
| 3 | d | 2 | 2(2 × 2 + 1) = 10 |
| 4 | f | 3 | 2(2 × 3 + 1) = 14 |
- La primera cáscara, es decir, la cáscara K, tendrá el número cuántico principal 1 y el orbital s, por lo que el orbital s se denomina 1s.
- La segunda concha, es decir, la concha L, tendrá el número cuántico principal 2 y tendrá una s y una p orbital y se denotan como 2s y 2p respectivamente.
- La tercera concha, es decir, la concha M, tendrá el número cuántico principal 3 y tendrá una s, una p y una d orbital y se denotan como 3s, 3p y 3d respectivamente y así sucesivamente.
- Aquí tenemos otra cosa para recordar que el orbital s tiene un suborbital y cada suborbital puede contener un máximo de dos electrones. El orbital p tiene 3 suborbitales y el orbital d tiene 5 suborbitales.
- El suborbital de menor energía se llena primero y luego se llena el siguiente orbital más alto. No habría ninguna posibilidad de llenar cualquier orbital o suborbital superior antes de que se complete el llenado en su orbital inferior.
Si repasamos los ejemplos siguientes, nos quedará claro.
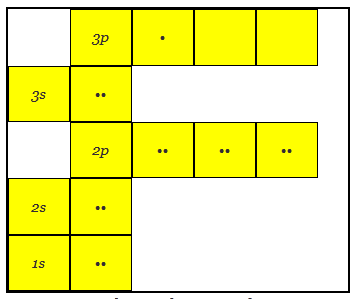
La estructura atómica del aluminio tiene 13 electrones

La estructura atómica del cobre tiene 29 electrones
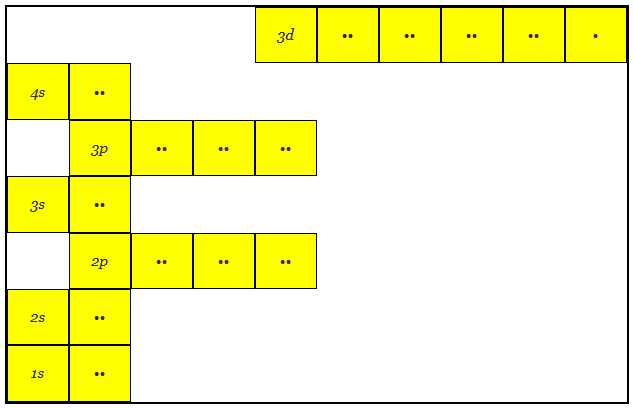

Aquí se puede notar que la órbita 3d está en un nivel de energía mayor que la 4s
La estructura atómica de la plata tiene 47 electrones
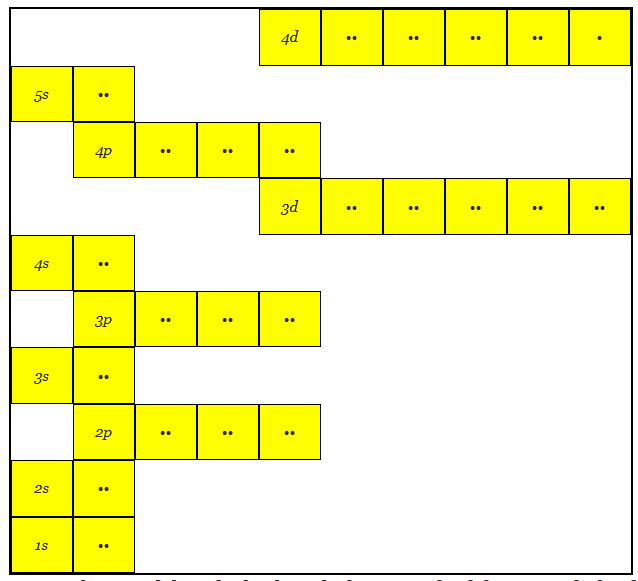

Aquí se puede notar que el orbital 3d está en un nivel de energía más alto que el 4s, de manera similar el orbital 4d está en un nivel de energía más alto que el 5s, de manera similar.
Teoría Atómica Moderna
La teoría atómica moderna está un poco más evolucionada que la teoría de los Daltons. La teoría atómica moderna también se llama la teoría cuántica. El concepto de la dualidad onda-partícula entra en escena aquí. Dice que los electrones que se consideran partículas a veces pueden comportarse como ondas. Así que un átomo tiene un núcleo que está rodeado de nubes de probabilidad. Estas nubes son las ubicaciones más probables de los electrones. El tamaño y la forma de estas nubes pueden ser calculados usando las ecuaciones de las ondas.