Funcionamiento de la batería de plomo
El almacenamiento batería o batería secundaria es aquella en la que la energía eléctrica puede ser almacenada como energía química y esta energía química se convierte en energía eléctrica cuando se requiere. La conversión de la energía eléctrica en energía química mediante la aplicación de una fuente eléctrica externa se conoce como carga de la batería. Mientras que la conversión de energía química en energía eléctrica para suministrar la carga externa se conoce como descarga de la batería secundaria.
Durante carga de la batería, actual se pasa a través de ella lo que causa algunos cambios químicos dentro de la batería. Estos cambios químicos absorben energía durante su formación.
Cuando la batería se conecta a la carga externa, los cambios químicos tienen lugar en dirección inversa, durante los cuales la energía absorbida se libera como energía eléctrica y se suministra a la carga.
Ahora trataremos de entender el principio funcionamiento de la batería de ácido de plomo y por eso primero discutiremos sobre batería de ácido de plomo que se utiliza muy comúnmente como batería de almacenamiento o batería secundaria.
Los materiales utilizados para las células de baterías de almacenamiento de ácido de plomo
Los principales materiales activos necesarios para construir una batería de plomo son
- El peróxido de plomo (PbO2).
- Plomo de esponja (Pb)
- El ácido sulfúrico diluido (H2SO4).
El peróxido de plomo (PbO2)
La placa positiva está hecha de peróxido de plomo. Esta es una sustancia marrón oscura, dura y quebradiza.
Esponja de plomo (Pb)
La placa negativa está hecha de plomo puro en estado de esponja suave.
El ácido sulfúrico diluido (H2SO4)
El ácido sulfúrico diluido utilizado para batería de ácido de plomo tiene una relación agua : ácido = 3:1.
El batería de almacenamiento de ácido de plomo se forma sumergiendo la placa de peróxido de plomo y la placa de plomo esponjosa en ácido sulfúrico diluido. Una carga está conectada externamente entre estas placas. En el ácido sulfúrico diluido las moléculas del ácido se dividen en iones de hidrógeno positivos (H+) y los iones sulfato negativos (SO4 ). Los iones de hidrógeno cuando llegan al PbO2 reciben electrones de ella y se convierten en hidrógeno átomo que vuelven a atacar al PbO2 y formar PbO y H2O (agua). Este PbO reacciona con el H2 SO4 y forma PbSO4 y H2O (agua).
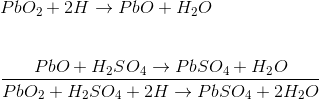
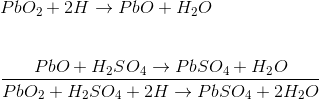
SO4 los iones se mueven libremente en la solución por lo que algunos de ellos llegarán a la placa de Pb puro donde dan sus electrones extra y se convierten en radicales de SO4. Como el radical SO4 no puede existir solo, atacará a Pb y formará PbSO4.
Como H+ los iones toman electrones del PbO2 placa y SO4 los iones dan electrones a la placa de Pb, habría una desigualdad de electrones entre estas dos placas. Por lo tanto, habría un flujo de corriente a través de la carga externa entre estas placas para equilibrar esta desigualdad de electrones. Este proceso se llama descarga de la batería de ácido de plomo.
El sulfato de plomo (PbSO4) es de color blanquecino. Durante la descarga,
- Ambas placas están cubiertas con PbSO4.
- La gravedad específica de la solución de ácido sulfúrico cae debido a la formación de agua durante la reacción en PbO2 plato.
- Como resultado, la velocidad de reacción cae, lo que implica que la diferencia de potencial entre las placas disminuye durante el proceso de descarga.
Ahora desconectaremos la carga y conectaremos el PbSO4 cubierto con PbO2 placa con el terminal positivo de una fuente externa de DC y PbO2 cubierto con una placa de Pb con el terminal negativo de esa fuente de DC. Durante la descarga, la densidad del ácido sulfúrico cae pero aún existe ácido sulfúrico en la solución. Este ácido sulfúrico también permanece como H+ y SO4 iones en la solución. Los iones de hidrógeno (catión) siendo cargados positivamente, se mueven al electrodo (cátodo) conectado con el terminal negativo de la fuente de DC. Aquí cada H+ El ión toma un electrón de eso y se convierte en un átomo de hidrógeno. Estos átomos de hidrógeno atacan entonces el PbSO4 y forman plomo y ácido sulfúrico.

SO4 los iones (aniones) se mueven hacia el electrodo (ánodo) conectado con el terminal positivo de la fuente de DC donde entregarán sus electrones extra y se convertirán en radicales de SO4. Este radical SO4 no puede existir solo, por lo tanto reacciona con PbSO4 del ánodo y forma peróxido de plomo (PbO2) y el ácido sulfúrico (H2SO4).

Por lo tanto, cargando la celda de la batería de almacenamiento de ácido de plomo,
- El ánodo de sulfato de plomo se convierte en peróxido de plomo.
- El sulfato de plomo del cátodo se convierte en plomo puro.
- Terminal; el potencial de la célula aumenta.
- La gravedad específica del ácido sulfúrico aumenta.