La configuración electrónica de un átomo representa que la forma en que los electrones se distribuyen en su átomo entre las órbitas (conchas) y sub-cascaras. El configuración electrónica de un átomo es muy importante ya que ayuda a predecir el comportamiento químico, eléctrico y magnético de la sustancia. Basándonos en la configuración electrónica del átomo, podemos predecir si dos sustancias reaccionarán químicamente o no y si reaccionan, también podemos predecir qué tipo de reacción es probable que ocurra y cuán fuerte será.
El configuración electrónica de un átomodescribe la disposición de los electrones en el espacio alrededor del núcleo. Los electrones están distribuidos en diferentes niveles de energía. Estos niveles de energía se llaman la cáscara o las órbitas.
Básicamente, la distribución de los electrones en varias capas (niveles de energía) es tal que, la energía global de todos los electrones de un átomo sigue siendo mínima para la estabilidad del átomo.
La distribución de los electrones en varios niveles de energía se rige por las siguientes reglas
- El número máximo de electrones en cualquier nivel de energía principal (cáscara) viene dado por, 2n2donde, n es un número entero y representa el número cuántico principal. Para los diferentes niveles de energía principal, el valor de n y el número máximo de electrones se dan en la tabla siguiente.
Sl. No. Nivel de energía u Órbita (caparazón) Número cuántico principal n Número máximo de electrones (2n2) 1 K 1 2×12 = 2 2 L 2 222 = 8 3 M 3 2×32 = 18 4 N 4 242 = 32
- Cada capa principal (nivel de energía) se subdivide en subcapas. Estas subcapas se llaman orbitales. Estas subcáscaras/orbitales se designan por s, p, d, f etc. con el correspondiente número cuántico orbital, l = 0, 1, 2, 3, 4,..(n-1) etc. El número de subcapas en cualquier caparazón principal es igual al número cuántico principal n.
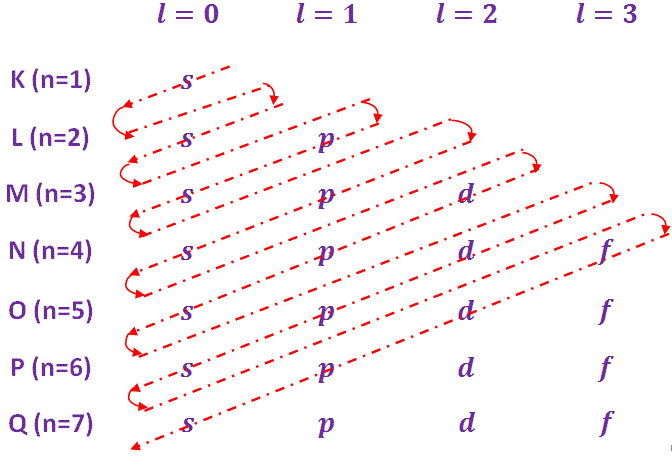
- La capacidad máxima de electrones de las subcáscaras se rige por la fórmula 2(2l + 1). La capacidad de las subcáscaras se indica en la tabla siguiente…
Sl. No. Subshell Número cuántico
(l)La capacidad de los electrones de la subcapa 2(2l+1)
1 s 1 2(2 × 0+1) = 2 2 p 2 2(2 × 1+1) = 6 3 d 3 2(2 × 2+1) = 10 4 f 4 2(2 × 3+1) = 14
- Principio de Aufbau
Aufbau es una palabra alemana cuyo significado se está acumulando. Por lo tanto, el principio de Aufbau también se llama principio de acumulación. Según este principio, los electrones ocupan los orbitales en el orden de la energía creciente. El orden de energía creciente de varios orbitales y el orden de ocupación es el siguiente
1s<2s<2p<3s<3p<4s<3d<4p<5s<4d<5p<6s<4f<5d<6p<7s<5f<6d<7p Para simplificar la comprensión del orden de la energía creciente, se utiliza la regla de Madelungs, que se da a continuación-
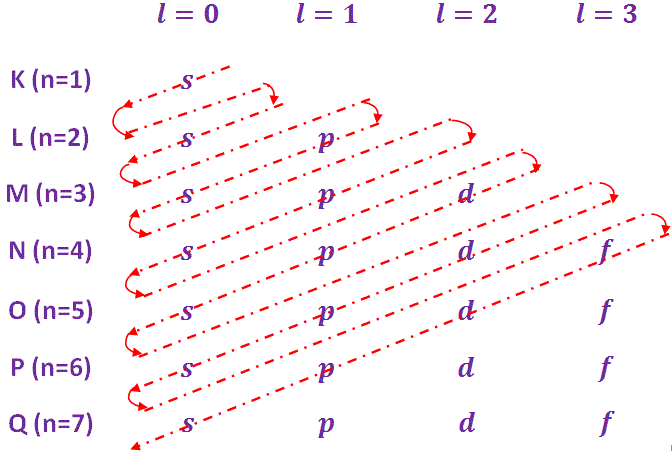
Basado en las reglas anteriores, el configuración electrónica del átomo de algunos elementos se muestra en el cuadro siguiente…
| Elemento | Símbolo químico | No atómico. | Distribución de electrones sobre las órbitas (conchas), 2n2 | Configuración electrónica del átomo | |||
| K(n=1) | L(n=2) | M(n=3) | N(n=4) | ||||
| Hidrógeno | H | 1 | 1 | 0 | 0 | 0 | 1s1 |
| Helio | Él | 2 | 2 | 0 | 0 | 0 | 1s2 |
| Litio | Li | 3 | 2 | 1 | 0 | 0 | 1s2 2s1 |
| Berilio | Se | 4 | 2 | 2 | 0 | 0 | 1s2 2s2 |
| Boro | B | 5 | 2 | 3 | 0 | 0 | 1s2 2s2 2p1 |
| Carbono | C | 6 | 2 | 4 | 0 | 0 | 1s2 2s2 2p2 |
| Nitrógeno | N | 7 | 2 | 5 | 0 | 0 | 1s2 2s2 2p3 |
| Oxígeno | O | 8 | 2 | 6 | 0 | 0 | 1s2 2s2 2p4 |
| Flúor | F | 9 | 2 | 7 | 0 | 0 | 1s2 2s2 2p5 |
| Neón | N | 10 | 2 | 8 | 0 | 0 | 1s2 2s2 2p6 |
| Sodio | Na | 11 | 2 | 8 | 1 | 0 | 1s2 2s2 2p6 3s1 |
| Magnesio | Mg | 12 | 2 | 8 | 2 | 0 | 1s2 2s2 2p6 3s2 |
| Aluminio | Al | 13 | 2 | 8 | 3 | 0 | 1s2 2s2 2p6 3s2 3p1 |
| Silicio | Si | 14 | 2 | 8 | 4 | 0 | 1s2 2s2 2p6 3s2 3p2 |
| Fósforo | P | 15 | 2 | 8 | 5 | 0 | 1s2 2s2 2p6 3s2 3p3 |
| Azufre | S | 16 | 2 | 8 | 6 | 0 | 1s2 2s2 2p6 3s2 3p4 |
| Cloro | Cl | 17 | 2 | 8 | 7 | 0 | 1s2 2s2 2p6 3s2 3p5 |
| Argón | Ar | 18 | 2 | 8 | 8 | 0 | 1s2 2s2 2p6 3s2 3p6 |
| Potasio | K | 19 | 2 | 8 | 8 | 1 | 1s2 2s2 2p6 3s2 3p6 4s1 O [Ar]4s1 |
| Calcio | Ca | 20 | 2 | 8 | 8 | 2 | 1s2 2s2 2p6 3s2 3p6 4s2 O [Ar]4s2 |
| Scandium | Sc | 21 | 2 | 8 | 8 | 2 | 1s2 2s2 2p6 3s2 3p6 3d1 4s2 O [Ar]3d1 4s2 |
Donde, [Ar] = 1s2 2s2 2p6 3s2 3p6 representa la configuración de electrones del Argón que ha llenado completamente las 3 capas. Se utiliza para simplificar la configuración electrónica de los elementos de mayor número atómico.