Modelo de budín de ciruela de Thomson es dada por el físico inglés Sir Joseph John J.J. Thomson. Descubrió el electrón (primera partícula subatómica) en el año 1897. En el momento del descubrimiento, J.J. Thomson llamó a esta partícula cargada negativamente como corpúsculos.
El Modelo de Pudín de Ciruela de Thomson es el primer modelo que representa la estructura atómica de la materia. De acuerdo con Modelo de budín de ciruela de Thomsonuna sustancia está compuesta por pequeñas esferas que tienen un radio de aproximadamente 10-10 m de diámetro. La carga positiva se reparte uniformemente en todo el volumen de la esfera llamada pudín. Las partículas cargadas negativamente Electrones llamados Ciruelas se distribuyen como cargas puntuales en las conchas como se muestra en la siguiente figura-
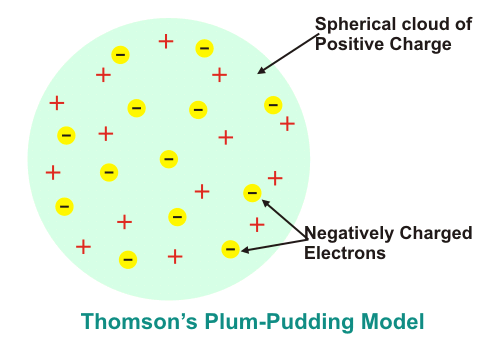

La esfera cargada positivamente ejerce la fuerza sobre los electrones cargados negativamente. La dirección de la fuerza neta sobre los electrones cargados negativamente debido a la esfera cargada positivamente es hacia el centro de la esfera. Estos electrones cargados negativamente se repelen entre sí y forman las capas.
Modelo de budín de ciruela de Thomson se mantuvo durante unos pocos años hasta que Ernest Rutherford anunció el modelo nuclear de la átomo en el año 1911. Después del modelo nuclear del átomo de Ernest Rutherfords en 1911, el interés por el modelo de la ciruela de Thomson cayó rápidamente. Pero el Modelo de Ciruelas de Thomson asumió su lugar en la historia como el primer intento moderno de construir una teoría de estructura atómica.
El Modelo de budín de ciruela de Thomson fue abandonado porque no explicaba la existencia de algunos fenómenos observados. Este modelo no logró explicar la emisión del espectro de electrones que consiste en diferentes frecuencias del átomo de Thomson cuando se somete a las frecuencias externas emitidas por otras sustancias.
Tampoco explica la existencia del espectro de la luz. Por ejemplo, consideremos la emisión de luz del hidrógeno átomo que tiene un solo electrón. De acuerdo con Modelo de budín de ciruela de Thomsonpuede emitir la luz a una sola frecuencia mientras que, prácticamente, emite el espectro de luz que consiste en diferentes frecuencias. Debido al fracaso del Modelo de Pudín de Ciruela de Thomson para explicar el fenómeno anterior, este modelo fue rechazado.
Aunque el Modelo de Pudín de Ciruela de Thomson representa un considerable progreso hacia la verdad del asunto, pero no explica estos hechos.
Además, no proporciona el mecanismo satisfactorio para explicar la desviación de la partícula. En el año 1911, el físico británico Ernest Rutherford dio
un modelo atómico que es capaz de explicar el fenómeno anterior, como el espectro de hidrógeno que consiste en diferentes frecuencias, el espectro de luz que consiste en diferentes frecuencias, la deflación de partículas en el campo externo. Por lo tanto, el modelo nuclear de Ernest Rutherfords de la átomo en 1911 reemplazó a la Modelo de budín de ciruela de Thomson.