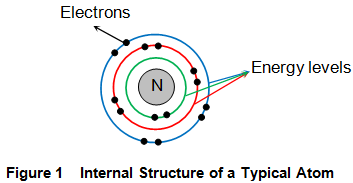
Átomos constituyen los bloques de construcción de todos los materiales existentes. En estos átomos, hay una porción central llamada núcleo (N en la figura 1) que consiste en protones y neutrones, alrededor de los cuales giran las partículas llamadas electrones. A continuación, hay que señalar que todos los electrones que constituyen el material considerado no giran por el mismo camino. Sin embargo, esto no significa que sus caminos revolucionarios puedan ser aleatorios. Es decir, cada electrón de un átomo particular tiene su propio camino dedicado, llamado órbita, a lo largo del cual circula alrededor del núcleo central. Son estas órbitas las que se denominan niveles de energía de un átomo.

Esto se debe a que cada uno de ellos posee una cantidad de energía dedicada que se expresa en términos de un múltiplo integral de la ecuación
Donde h es la constante de Plancks y es la frecuencia.
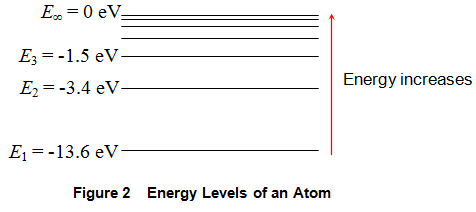
La figura 2 muestra la energía finita que poseen los diferentes estados de energía (y por lo tanto todos los electrones presentes en ellos) en electrón-voltios (eV). En la figura se puede ver que la energía de los electrones aumenta a medida que uno se aleja del centro de la átomo. Por ejemplo, un electrón en el primer estado de energía (E1) tiene una energía de -13,6 eV, que en el segundo (E2) poseen una energía de -3,4 eV y así sucesivamente. Continuando así, se puede llegar a un nivel en el que la energía se convierte en 0 eV, es decir, el nivel de energía E∞.

Ahora supongamos que estamos suministrando energía externa (podría ser de cualquier manera incluyendo la de la luz) a la materia. Esta energía suministrada será absorbida por los electrones presentes en los átomos que constituyen el material. Sin embargo, no se deja que los electrones absorban ninguna cantidad de energía como desean. Esto se debe a que, si un electrón absorbe algo de energía, entonces su energía neta cambia. Este cambio significa que el electrón ya no puede permanecer en su nivel de energía original. Digamos, por ejemplo, que un electrón en el estado de energía E1 absorbe 4 eV de energía. Al hacerlo, la energía neta del electrón aumentaría a
debido a lo cual ya no puede permanecer en el nivel de energía E1 que tiene su energía como -13,6 eV. Además no puede ver ningún otro nivel que tenga una energía equivalente a la que tiene. ¡Esto hace que pierda la pista!
Por otro lado, si este electrón absorbe una energía de 10,2 eV, entonces su energía aumentada sería
Esto no es más que la energía que posee el nivel E2lo que significa que el electrón que antes estaba en E1 está ahora en el nivel de energía E2. En otras palabras, decimos que este electrón ha hecho una transición desde el nivel E1 al nivel E2 que a su vez conduce a un átomo excitado. Sin embargo, el electrón no puede permanecer en este estado inestable por mucho tiempo. Pronto volverá a su estado original haciendo una transición desde el nivel E2 al nivel E1. Pero un punto importante que hay que señalar aquí es el hecho de que al hacerlo, el electrón emite una energía de 10,2 eV (que es la misma que la de los absorbidos) en forma de ondas electromagnéticas.
De la discusión presentada, es evidente que a los electrones se les permite absorber (o emitir de manera equivalente) sólo cantidades cuantificadas de energía. La cantidad de esta energía no es más que la diferencia de las energías de los niveles entre los que se produce la transición. A continuación, en la figura 2, se ve que esta diferencia entre los estados de energía va disminuyendo a medida que uno se aleja de E1 es decir.
Esto significa que los electrones de las capas más externas requieren menos energía para excitarse que los de las capas más internas. Esto está de acuerdo con el hecho bien conocido de que los electrones presentes cerca del núcleo están fuertemente ligados al átomos en lugar de los que están presentes lejos de ella.
Aunque hemos explicado el proceso de excitación, el mismo modo de argumentación es válido incluso para el caso de la liberación, ya que podemos asumir que el electrón cuando se excita hasta el nivel de energía con una energía de 0 eV (E∞), estaría completamente libre de la fuerza de atracción del núcleo de los átomos. Son estos electrones libres los que contribuyen a la conducción en el caso de materiales como los metales.



